서론
개인과 창상에 영향을 미치는 내인성 및 외인성 요인으로 인해 치유 단계가 느리게 진행되거나 지연 또는 정지된 창상을 만성 창상이라 정의한다[1]. 대개의 만성 창상에는 육안으로 보이지 않는 다양한 세균 및 진균 종의 미생물 군집인 바이오필름이 일정 수준으로 있으며[2], 이것은 만성감염을 일으킬 뿐 아니라 숙주의 면역 반응으로부터 스스로를 보호하고 항생제와 소독제에 내성을 보인다. 바이오필름은 창상 표면에 몇 시간 내에 형성되고 48–72시간 내에 성숙에 도달하여 일부가 제거되더라도 빠르고 광범위하게 재형성되며, 창상 기저부에서의 육아조직 형성 및 상피세포 이동을 지연시키면서 창상 치유를 막는 중요한 요인으로 작용한다[1,3,4]. 바이오필름의 역할에 대한 이해 및 이에 대한 진단과 치료법의 개발은 아직 초기 단계이나, 치유되지 않는 만성 창상에는 높은 확률로 바이오필름이 포함되어 있고 이것이 어떤 식으로든 창상 치유를 지연시키거나 방해하고 있으므로 치유의 시작을 위해서는 바이오필름 제거에 기반을 둔 적절한 관리가 필요하다는 것이 널리 받아들여지고 있다[5].
2019년 런던에서 열린 국제 창상관리 전문가 자문위원 회의(Advisory Board Meeting)에서 제시된 개념 및 실천 방법을 정리한 합의문(consensus document)을 통해[6] 치유가 어려운 창상을 관리함에 있어 구강위생처럼 “반복적이고 규칙적으로 빈번히 필수적으로” 해야 함을 의료진에게 상기시키는 용어로 “창상 위생(Wound Hygiene)”이라는 개념이 발표되었다. 창상 위생의 핵심 원칙은 창상에서 바이오필름, 괴사조직, 이물질을 포함하여 원하지 않는 모든 물질을 제거하거나 최소화하고, 남은 바이오필름을 처리하고, 재형성을 방지하여 치유의 진행을 도모하는 것이다. 이를 위한 전략으로 먼저 창상과 주위 피부까지 효과적으로 세척하고, 드레싱 교체 시마다 괴사조직과 바이오필름을 제거하며, 상피세포의 전진과 창상수축을 위해 창상 가장자리를 재정돈하고, 바이오필름 막이 파괴된 틈을 이용하여 바이오필름 재성장을 막기 위한 항균 드레싱을 시행하는 것을 제시하였다[6,7].
이 종설에서는 만성 창상의 위생을 위한 첫 번째 단계인 창상 세척과 소독제에 대한 임상적 연구 및 전문가 의견에 대한 분석을 바탕으로 바이오필름으로 인한 치유의 장벽을 극복하기 위한 구체적인 관리 방법들을 제시하고자 한다. 본 종설에 사용된 환자 사진은 연구와 출판 목적으로 사용될 수 있음을 설명하고 사전 동의를 얻었다.
창상 세척
창상 세척 목적
세척은 창상 표면과 주변 피부의 오염 물질이나 느슨한 파편(debris), 부육(slough), 부드러운 괴사조직, 미생물, 이전 드레싱 잔여물들을 적극적으로 제거하는 것이다[8]. 이는 박테리아 부하를 줄이며 바이오필름 활동을 방지하여 창상 환경을 최적화하기 위한 창상 기저부 준비의 필수적인 부분이자 창상 관리의 첫 시작이 된다[9]. 창상 세척은 드레싱 교체 시마다 반복적으로 시행하며, 시각적 창상 사정을 돕기 위해, 창상 도말 검사에 앞서 창상 기저부 준비를 위해, 보존적 괴사조직 제거술 후 남아 있는 파편들을 제거하기 위해서도 시행한다[10,11].
창상 세척 유형
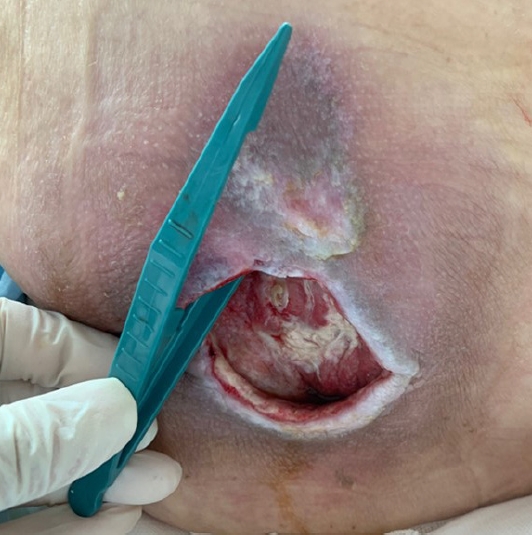
창상 세척에는 거즈, 모노필라멘트 섬유 패드(monofilament fiber pad), 브러시 등을 이용한 문지르기(Fig. 1A) 또는 주사기와 바늘, 스프레이 형태의 세척 시스템(wound irrigation system), 박동성 세척기(pulsed lavage)와 같은 도구를 사용하는 세척액 관류를 통한 세척(Fig. 1B and C) 방법이 주로 사용된다[7]. 두 가지 방법 중 세척액 관류를 통한 세척이 문지르기 방법보다 창상 치유 시간을 단축하여 비용 효율적이며, 환자의 통증을 덜 유발하고 편안함을 주는 방법이 되겠다[12].
창상 세척 용액
창상 세척 용액을 선택할 때 항균 작용과 세포 독성의 균형을 고려하는 것이 중요한 데 많은 경우 세포 독성이 없는 이상적인 세척액으로 생리식염수를 사용하고 있다. 그러나 이를 통해서는 바이오 필름이 제거되지 않기에, 바이오필름 감소를 위해서는 계면활성제나 항바이오필름 기술이 포함된 창상 및 피부 관리용 항균 용액을 사용해야 한다[6,15].
계면활성제는 액체와 고체(조직 파편 및 바이오필름 포함) 사이의 표면장력을 낮추어 바이오필름 막을 분산시키는 데 도움이 되나, 세정력과 세포 독성이 정비례하므로 균형을 고려하는 것이 중요하다[15,16]. 소독제(antiseptics)는 미생물 성장을 억제할 목적으로 피부 또는 기타 살아있는 조직에 적용하는 화학물질로 농도 및 노출 기간에 따라 세포에 독성을 미칠 수 있으며, 내성 발현은 드물다[7,17]. 소독제의 경우 광범위하고 우수한 항균 효과와 낮은 세포독성이 중요하며 알레르기 반응이나 통증과 같은 민감 반응을 일으키지 않으면서 유기 물질이 존재하는 경우에도 효과적이어야 한다. 또한, 인체 조직에 사용하기에 안전하며 내성을 일으키지 않고 비용 효율적인 것을 선택하여 사용해야 한다[17,18]. International Wound Infection Institute에서 2022년 발표한 국제 합의문에 따르면[7], 농축 계면활성제 겔, 의료용 꿀, 포비돈 요오드(povidone-iodine), 옥테니딘 이염산염(octenidine dihydrochloride, OCT), 폴리헥사나이드(polyhexanide, polyhexamethylene biguanide, PHMB), 차아염소산나트륨(sodium hypochlorite), 차아염소산(hypochlorous acid)이 창상 세척에 흔히 사용되는 소독제라 하였다. 2022년 Cwajda-Bialasik 등[19]의 만성 창상 치료와 관리를 위한 소독제 및 항균제에 관한 임상시험의 체계적 문헌고찰에 따르면 세척을 위해서 OCT 기반 세척액이나 폴리헥사나이드 또는 차아염소산염(hypochlorite) 사용을 권장하고 있다. 이처럼 다양한 소독제들 중에 올바른 선택에 도움이 되는 것으로 생체 적합성 지수(biocompatibility index, BI)가 있으며, 이 값이 1보다 큰 경우 미생물에 대한 광범위한 스펙트럼 활성과 섬유아세포 또는 각질세포에 대한 낮은 수준의 세포독성을 가져 치유 과정에 악영향을 미치지 않음을 의미하는데 이러한 사항을 충족하는 소독제로 OCT(BI 1.7–2.1)와 폴리헥사나이드(BI 1.4–1.5)가 있다[20,21].
OCT는 1분이라는 짧은 시간에 세균과 진균의 살균이 가능한 제품이다. 탁월한 항균 효과로 다재내성 균주에 의해 집락화된 창상을 포함하여 급성, 외상 및 감염된 창상을 치료하는 데 적합하다. 계면활성제가 첨가된 OCT의 경우 강력하고 효과적인 항바이오필름 효과가 있어 바이오필름을 제거 및 증식을 방지할 수 있고, 내성이 나타나지 않아, 신생아, 미숙아, 임산부, 수유부에서 사용 시 안전성과 유효성이 확인되었다[17,22]. 창상 세척용으로 0.05%, 급만성 감염창상 치료를 위해 0.1%의 농도가 사용된다[17]. 폴리헥사나이드는 광범위한 항균력을 가지며 내성을 일으키지 않고, 베타인이라고 하는 계면활성제가 포함된 소독제이다. 이는 소수성 원리를 이용하여 바이오필름 막의 표면장력을 낮추어 막을 파괴하고 소독제에 노출되게 하여 항균 효과를 유발한다. 단, 만성 창상에서 이러한 효과가 나타나려면 적어도 15분 정도 충분히 소독액에 덮여 있어야 한다[6,17]. 보통 0.02%, 0.04%, 0.1% 농도의 겔 또는 세척액의 형태로 제품화되어 있다[17]. 포비돈 요오드는 오늘날 가장 일반적으로 사용되는 요오드 화합물로 1–5분 이내에 살균 효과가 나타나지만, 짧은 시간으로는 바이오필름에 효과적이지 않아 15분 동안은 노출시켜야 그람(Gram) 양성 및 음성 바이오필름에 효과가 있다. 신생아, 어린아이, 임산부, 수유 중인 산모, 갑상선 질환이 있거나 요오드 방사선 요법으로 치료 중인 환자에게는 사용하지 말아야 한다[17]. 포비돈 요오드는 희석됨에 따라 유리 요오드 농도가 증가하여 희석 용액(0.1%–1%)이 10% 용액보다 빨리 작용한다[21]. In vitro 상 1% 농도에서 Pseudomonas aeruginosa와 Staphylococcus aureus를 포함한 바이오필름의 침투와 파괴가 가능하였고, 0.25%에서도 S. aureus, Klebsiella pneumoniae, P. aeruginosa, Candida albicans 바이오필름이 박멸되었다[7]. 이러한 포비돈 요오드는 농도나 노출 기간에 따라 세포독성이 달라지므로 적절한 농도의 선택이 중요하다[11]. 이외에도 오래전부터 사용해 온 과산화수소(hydrogen peroxide), 전통적인 차아염소산나트륨(EUSOL 및 Dakin 용액) 및 클로르헥시딘(chlorhexidine) 등이 있으나 이러한 소독제는 조직 손상 위험이 있어 낮은 농도의 용액을 사용해야 하며 창상이 용액에 반응하면 사용을 중단해야 한다[7].
창상 세척 방법
조직이 약화되거나 바이오필름이 의심되는 치유하기 어려운 만성 창상은 창상 부위의 외상은 피하면서 느슨한 조직, 미생물 또는 파편들을 창상 바닥에서 제거하기 위해 강력한 치료적 세척이 필요하다[13,23]. 이때 세균을 조직 안으로 밀어 넣지 않으면서 표면 파편들을 제거할 수 있는 적절한 힘은 4–15 psi (pounds per square inch)이다[11]. 세균 제거를 위해서는 15 psi 정도의 강한 힘으로, 깨끗한 창상의 경우에는 낮은 힘으로 세척하며[8], 다양한 크기의 주사기와 바늘 조합을 통해 힘을 조절할 수 있는데 20 cc 주사기에 18 게이지 바늘을 적용시 12 psi 정도의 힘으로 세척이 가능하며 일반적으로 주사기가 클수록 압력은 낮아지고 바늘이 커질수록 압력은 높아진다[15].
대부분의 세척 용액은 잔해물을 용해시키고 바이오필름 제거를 돕기 위해 약간의 체류 시간 또는 담금질(soaking)이 필요하다[24]. 느슨하게만 붙어 있거나 활력이 없는 조직은 계면활성제 기반의 창상 용액이나 젤로 충분한 시간(보통 10–15분) 동안 덮고 멸균 거즈로 가볍게 세척하면 제거가 용이하다[16]. 세척 용액 사용 시 제조 업체의 지침을 따르면서 충분한 세척 시간 확보를 위해 거즈가 젖을 때까지 용액에 담근 다음 드레싱 교환을 위해 드레싱 트레이와 장비를 준비하는 동안 창상에 그대로 두는 방식을 사용하는 것이 도움이 된다[24]. 세척액의 양은 대략 창상 cm2 당 50에서 100 mL를 충분히 사용하며[13,25,26], 개봉 후 24시간이 지난 세척액은 재사용하지 말고, 창상 조직 온도가 33 °C 미만으로 떨어지면 세포의 유사분열 활성에 부정적인 영향을 미치므로 세척액의 온도를 체온 정도로 유지한다[27].
세척은 최대한 무균술을 따라 시행하는데 교차오염에 주의하며 문지르기 방법을 사용할 때에는 위에서 아래로, 안에서 밖으로 원을 그리며 닦고, 세척액에 오염된 천을 다시 창상 부위에 넣지 않는다. 관류 세척 시 세척 후 용액이 창상 부위를 다시 오염시키지 않도록 오염액을 모을 수 있는 용기나 흡수 패드를 적용하며, 세척제 또는 장치를 사용할 때 에어로졸이 생성되거나 튈 수 있으므로 시행자는 항상 개인 보호 장비(personal protective equipment)를 착용한다[11,13,14]. 종종 세척하는 행위가 환자에게 심한 불편과 통증을 야기할 수 있으므로 격렬한 세척을 시도하기 전에 국소 마취제를 사용하거나 최소한의 자극으로 이물질 및 괴사조직 제거가 가능해 통증 조절에 유용한 계면활성제가 포함된 세척액을 사용도록 한다[28].
결론
과거 바이오필름에 대한 깊은 이해가 있기 전에는 창상을 관리하는데 부드러운 보살핌이 필요한 정원의 꽃에 비유하거나, 눈에 넣지 못하는 것은 창상에 사용하지 말아야 한다라는 믿음들이 있었다[6]. 그러나 바이오필름이라는 강한 생명력의 끈질긴 막이 존재하는 만성 창상을 관리함에 있어서는 조기에 적절한 계면활성제나 소독제를 선택하여야 한다. 그리고 이것들이 작용할 수 있는 시간적 여유를 가지고 창상뿐 아니라 주변 피부까지 넓게 포함한 부위를 확실하게 세척함으로써 바이오필름 장벽을 무너트리고 이후 일련의 창상 위생의 과정을 당연한 일상처럼 규칙적이고 빈번하게 반복함으로써 창상 치유 진행의 발판을 마련할 수 있을 것이다.